L'ACTIVITÉ ANTI-CANCER D'ARTEMISIA
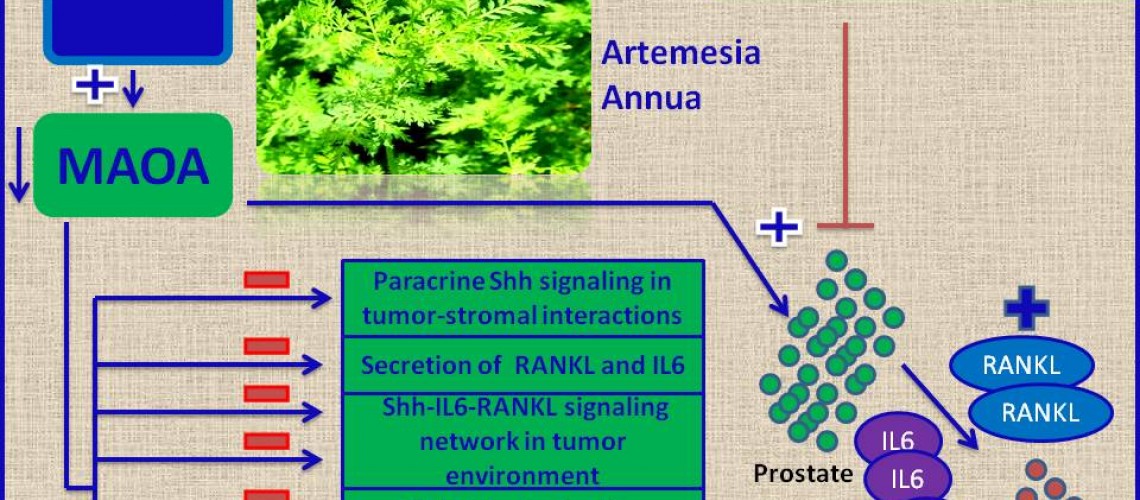
L'artémisinine est un extrait de la plante Artemisia annua. Avec leurs dérivés semi-synthétiques, ils forment un groupe de médicaments antipaludiques bien connus et efficaces. Des études récentes ont documenté l'effet anticancéreux potentiel de l'artémisinine et de ses dérivés (ART). Cette revue résume les résultats des études précliniques, documentant les mécanismes d'action anticancéreuse des ART et des études cliniques axées principalement sur l'efficacité, l'innocuité et la gamme de doses des ART en tant que chimiothérapie anticancéreuse. Les principaux mécanismes d'action des ART sont la production d'espèces réactives de l'oxygène, l'inhibition du cycle cellulaire en phase G0/G1, l'induction de l'apoptose et l'inhibition de l'angiogenèse. Les études d'innocuité n'ont montré aucune toxicité manifeste et une faible incidence d'effets indésirables. Le potentiel des ART à inhiber la croissance des tumeurs solides suggère leur application dans le traitement néoadjuvant. La dihydroartémisinine et l'artésunate présentent des effets chimiosensibilisants in vivo sur les cellules cancéreuses du sein, du poumon, du pancréas et du gliome, proposant l'utilisation des ART également dans la thérapie anticancéreuse combinée.
Le cancer reste une cause majeure de décès, avec les maladies cardiovasculaires et respiratoires en Europe. Avec le vieillissement de la population, le risque de cancer augmente et aussi la recherche de nouvelles chimiothérapies visant à lutter contre le cancer. Ce sont principalement les patients atteints de cancers hautement métastatiques et agressifs qui bénéficient de médicaments alternatifs à la chimiothérapie conventionnelle, auxquels les cellules cancéreuses développent couramment une résistance aux médicaments. Les herbes connues depuis longtemps et utilisées aujourd'hui dans la médecine traditionnelle chinoise sont une grande source de substances actives et ont pour objectif de rechercher de nouvelles chimiothérapies contre le cancer.
L'Artemisia annua est une plante médicinale chinoise bien connue, souvent utilisée pour traiter la jaunisse et l'hépatite, ainsi que pour réduire la fièvre, les nausées, les maux de tête et la transpiration excessive causée par la chaleur estivale, les infections parasitaires et le paludisme. Les premiers textes chinois à base de plantes, datant de 168 av.
En médecine occidentale, l'artémisinine est largement utilisée dans le traitement du paludisme. Les recommandations de l'OMS incluent une thérapie combinée à base d'artémisinine comme traitement de première intention du paludisme simple à Plasmodium falciparum. Il est bien toléré et aucun effet secondaire significatif n'est enregistré. Plusieurs études ont montré que l'artémisinine et ses dérivés (ART) ont une action contre les virus et autres parasites, comme Schistosoma ou Leishmania, mais aussi contre le cancer. Les observations selon lesquelles l'artémisinine inhibe la croissance de nombreuses lignées cellulaires transformées ont conduit à l'hypothèse que le médicament peut également être utile pour le traitement de la néoplasie humaine.
En ce qui concerne les effets antipaludiques, les mécanismes exacts derrière les activités anticancéreuses des ART restent flous. Cependant, la présence d'un pont endoperoxyde et la production d'espèces réactives de l'oxygène (ROS) est suggérée comme une caractéristique importante non seulement dans l'action antipaludique, mais aussi dans la lutte contre les cellules cancéreuses. Le but de cette revue était de résumer les connaissances actuelles sur les mécanismes d'action anticancéreux de l'artémisinine et les essais cliniques évaluant son efficacité. La revue est basée sur la recherche PubMed d'articles avec les mots clés « anticancer artemisinin », « cancer artesunate », « cancer dihydroartemisinin », « artemisinin mécanisme », « artemisinin cancer combination » et les termes « artemisinin », « artesunate », « dihydroartémisinine » à ClinicalTrials.gov.
Artémisinine en association avec d'autres médicaments anticancéreux
La chimiothérapie d'association est maintenant la norme de soins dans le but de maximiser l'efficacité tout en minimisant la toxicité systémique. De multiples mécanismes d'action de l'ART, différents de la chimiothérapie traditionnelle, proposent la possibilité d'une synergie efficace entre les deux. Il a été rapporté que des lignées cellulaires cancéreuses résistantes deviennent sensibles en ajoutant de l'artémisinine et ses dérivés au traitement conventionnel (chimiosensibilisation). L'artésunate a démontré sa capacité à sensibiliser les cellules cancéreuses du sein à l'épirubicine d'une manière autophagique dépendante de la cascade. En revanche, l'artésunate n'a pas augmenté de manière significative la cytotoxicité du docétaxel, un autre médicament anticancéreux couramment utilisé dans le cancer du sein.
Shuang-Jia Wang et al. (2010) ont démontré dans leur étude une synergie de la dihydroartémisinine et de la gemcitabine dans les cellules cancéreuses du pancréas. Une augmentation significative de l'apoptose, une diminution de l'indice Ki-67, une diminution de l'activité NF-ĸB et ses produits géniques connexes tels que c-myc, cycline D1, Bcl-2, Bcl-xL se sont manifestés. L'inhibition de l'activation de NF-ĸB induite par la gemcitabine est considérée comme le principal mécanisme par lequel la dihydroartémisinine agit en synergie avec la gemcitabine contre les cellules tumorales pancréatiques.
L'association efficace de la dihydroartémisinine et de la chimiothérapie traditionnelle utilisée pour le traitement des carcinomes pulmonaires, du cyclophosphamide et du cisplatine a été démontrée dans des modèles de carcinome pulmonaire de Lewis murin et de cancer du poumon humain non à petites cellules chez la souris. Les deux combinaisons à fortes doses de dihydroartémisinine et de cyclophosphamide et de dihydroartémisinine et de cisplatine ont induit une réduction significative du volume tumoral par rapport à l'une ou l'autre des thérapies seules. De plus, l'incidence des métastases pulmonaires spontanées a été complètement inhibée par l'association de dihydroartémisinine et de cyclophosphamide.
La dihydroartémisinine a potentialisé l'effet cytotoxique du témozolomide sur les cellules de gliome, principalement en générant des espèces réactives de l'oxygène. La dihydroartémisinine a augmenté de manière dose-dépendante l'apoptose et la nécrose induites par le témozolomide. De plus, une augmentation de l'apoptose a été observée dans les cellules d'hépatome humain HepG2 (type sauvage p53), Huh-7, BEL-7404 (mutant p53) et Hep3B après traitement avec deux combinaisons : dihydroartémisinine et gemcitabine, et artémisinine et gemcitabine. De même, dans des modèles murins de carcinome hépatome humain, les deux combinaisons ont significativement diminué la croissance tumorale. Dans tous les modèles de xénogreffe, la dihydroartémisinine a montré des effets thérapeutiques dose-dépendants plus importants que l'artémisinine.
Ces éléments de preuve suggèrent que les ART, principalement la dihydroartémisinine et l'artésunate, ont des effets chimiosensibilisants et proposent leur utilisation future dans la lutte contre les carcinomes chimiorésistants.
Etudes cliniques
À ce jour, il existe un grand nombre d'études in vitro et in vivo décrivant les effets anticancéreux de l'ART avec des résultats encourageants. Plusieurs rapports de cas ont également été publiés, documentant l'effet réducteur des TAR sur la taille et la croissance des tumeurs. Cependant, seuls quelques essais cliniques avec des patients atteints de cancer ont été achevés et leurs résultats publiés. Les plus étudiés sont les patients atteints de tumeurs solides : carcinome colorectal, cancer du sein, carcinome hépatocellulaire et cancer du poumon. Différents essais cliniques, principalement de phases 1 et 2, sont en cours, recrutant également des patients atteints de néoplasie intraépithéliale. Le tableau I résume les résultats des essais cliniques terminés et des essais en cours. Il comprend le nombre de patients participants, le médicament spécifique, la dose et la voie d'administration.
Zhang ZY et al. Ils ont recruté 120 patients atteints de CBNPC, répartis au hasard en un groupe témoin recevant NP (un schéma de chimiothérapie à base de vinorelbine et de cisplatine) et un groupe d'essai, traité par artésunate associé à une chimiothérapie. Au moins deux cycles de traitement de 21 jours ont été effectués. Les résultats n'ont pas montré de différences significatives dans le taux de survie à court terme, le temps de survie moyen et le taux de survie à 1 an entre le groupe d'essai et le groupe témoin. Cependant, des différences significatives sont apparues dans le taux de contrôle de la maladie. Le taux de contrôle de la maladie du groupe expérimental (88,2 %) était significativement plus élevé que celui du groupe témoin (72,7%) (p < 0,05). De plus, le délai de progression du groupe test était de 24 semaines significativement plus long que celui du groupe témoin (20 semaines). Aucune différence significative de toxicité entre les deux groupes n'a été trouvée, telle qu'une myélosuppression ou une réaction de digestion, conduisant à la conclusion que l'artésunate semble être sans danger pour une utilisation dans le traitement du CBNPC.
Les résultats d'une autre étude d'innocuité et d'efficacité ont été publiés en 2011 par Jansen FH et al. Les patientes atteintes d'un cancer avancé du col de l'utérus ont été traitées par voie orale à l'arténimol-R (dihydroartémisinine) pendant 28 jours et les taux de marqueurs tumoraux ont été mesurés plus tard. Une diminution de l'expression de l'antigène p53, EGFR et Ki-67, un marqueur de prolifération cellulaire, a été mise en évidence. De plus, le nombre de vaisseaux sanguins colorés par l'anticorps CD31 a été réduit, tandis que l'expression de la protéine du récepteur de la transferrine 1 (CD71) a augmenté. Le traitement par la dihydroartémisinine a induit une rémission clinique chez tous les patients, avec un délai moyen de disparition des symptômes de 7 jours. Bien que les résultats de cette étude soient encourageants, le nombre de patients participant à cette étude est faible et un essai clinique avec un plus grand groupe de patients est nécessaire pour obtenir des résultats plus fiables.
L'effet anticancéreux et la tolérabilité de l'artésunate par voie orale chez les patients atteints d'un cancer colorectal ont été évalués dans un essai clinique unique, randomisé, en double aveugle, contrôlé par placebo. Vingt patients ont terminé l'essai selon le protocole. Ils ont reçu 14 doses quotidiennes d'artésunate par voie orale (200 mg) ou un placebo en préopératoire avant la résection curative d'un carcinome colorectal primitif unique. Le critère de jugement principal (apoptose significative dans les cellules épithéliales de l'échantillon tumoral définie comme > 7 % de cellules présentant des caractéristiques apoptotiques) a été atteint chez 55 % des patients recevant le placebo et 67 % des patients traités par artésunate. Avec des résultats secondaires encore plus encourageants : l'artésunate a manifesté une probabilité très élevée (0,97, calculée avec un fond en analyse bayésienne) d'effet sur la coloration Ki-67 des cellules tumorales (le Ki-67 étant un marqueur de la prolifération cellulaire des tumeurs) et une probabilité de 0,79 pour augmentation de l'expression de CD31. Et il y avait une baisse d'environ 75 % des taux circulants de CEA après 2 semaines de traitement à l'artésunate seul dans un cas. La même équipe a lancé en octobre 2016 une étude sur la tolérance et l'efficacité de l'artésunate préopératoire dans le cancer colorectal de stade II/III, en recrutant 200 patients, avec des critères d'inclusion similaires à la précédente étude de 2014. 5 ans après le traitement par artésunate pour revoir l'effet de l'artésunate sur la survie sans récidive des patients et la sécurité et la tolérance de l'artésunate. Un autre essai clinique de phase 2 recrutant des patients atteints d'un cancer colorectal de stade II/III confirmé histologiquement en attente d'un traitement chirurgical est en cours à l'hôpital militaire central 108 au Vietnam. L'artésunate sera administré par voie orale à la dose de 200 mg une fois par jour pendant 14 jours chez les patients en attente d'un traitement chirurgical à visée curative et la survie sans récidive 2 ans après la chirurgie sera comparée au groupe témoin placebo comme critère d'évaluation principal.
Une conception d'escalade de dose rapide a été utilisée pour déterminer la dose maximale tolérée d'artésunate intraveineux pour le traitement de 19 patients atteints de différentes tumeurs solides. Cette étude de phase 1 a débuté en janvier 2015 à l'Université de Georgetown.
Conclusion et perspectives futures
Les ART représentent un groupe de médicaments antipaludiques efficaces avec un excellent profil d'innocuité. Ses propriétés anticancéreuses ont été documentées dans plusieurs études pré-cliniques et cliniques. Les ART réduisent efficacement la croissance des tumeurs solides en inhibant l'angiogenèse, en induisant l'apoptose et la ferroptose, en produisant des espèces réactives de l'oxygène et en induisant l'arrêt du cycle cellulaire. À mesure que les technologies de recherche nouvelles et modernes progressent, des informations plus détaillées sur les différents mécanismes d'action des ART augmentent. Le nombre actuel d'essais cliniques augmente et les résultats sont encourageants. Les TAR peuvent devenir une alternative pour le traitement adjuvant ou néoadjuvant des tumeurs solides, en particulier du sein, du pancréas, du côlon ou du poumon et d'autres types de cancer. L'effet régressif possible sur les néoplasies intraépithéliales cervicales et anales peut conduire à des procédures de traitement moins invasives. L'effet chimiosensibilisant de l'artésunate et de la dihydroartémisinine suggère l'utilisation des TAR comme thérapie d'appoint en combinaison avec les chimiothérapies conventionnelles et devrait être étudié dans les futurs essais cliniques. Les ART peuvent représenter l'un des nombreux exemples de pouvoir caché dans les sources naturelles et, après de nombreuses années de recherche, peuvent devenir de nouveaux médicaments anticancéreux prometteurs, développés et introduits, espérons-le, pour une utilisation clinique dans un avenir proche.















































